来源:药通社
药物临床试验是药物研发过程中耗时最长,投入资金最多和智力资本最高的阶段。可惜的是,即便开发者投入大量的资源,临床试验并非总能成功。但更可惜的是,同一类靶点往往参与者众多,但很少有企业原因主动公开失败的数据和原因,使得研发路上的同一个坑,后来者依然急切地往里跳,浪费了巨大的社会资源。
了解临床失败的原因以及如何避免对于减少临床发展中的损耗至关重要。
在对2013年-2015年174份具有明确失败原因的临床试验进行分析发现,大多数失败的原因是由于缺乏有效性(52%)或安全性(24%),其他失败的原因包括战略(15%),商业(6%)和运营(3%)。
按治疗领域细分,失败率最高的领域分别是肿瘤(32%),中枢神经系统疾病(17%)和肌肉骨骼疾病(13%),另外还有而心血管疾病( 7%),消化性疾病(7%),代谢性疾病(6%)和传染性疾病(5%)。
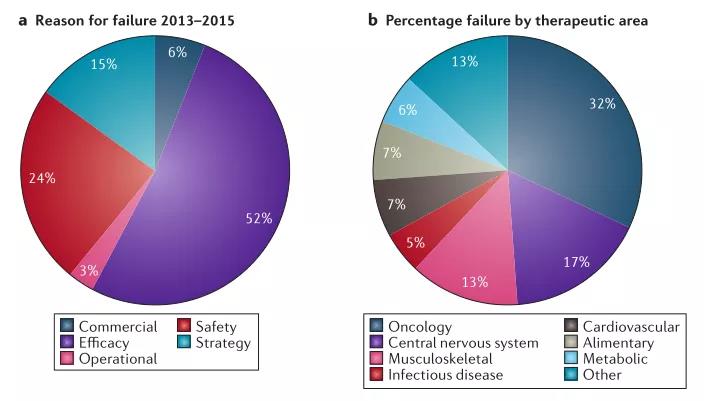
图1:临床失败原因
(来源:Nat Rev Drug Discov . 2016 Dec;15(12):817-818)
而纵观整个临床研究,失败的主要原因可归结为以下八大因素:
功效不足/安全问题(无法控制)
在高水平分析中,大多数药物由于疗效不足(48%)或安全问题(25%)而在 III 期停药。综合起来,这些原因占到所有II、III阶段失败的73%。而这些数据表明大多数负面结果可能反映了研究药物的内在特性,并不是每一个产品都会有预期的作用或效果。对于临床前任何一款展示出巨大潜力的药物,都可能在大规模临床验证中翻车。即便是翻车后有的项目也可再抢救一下,例如因临床无效导致失败的项目并不意味着对所有病人都无效,仅仅是统计学无效,因此可以进一步筛查找到试验中的有效病人体内的生物标志物,以此筛选到最合适的病患群体,起死回生。
研究设计不恰当(可以控制)
良好的试验设计不能将劣药变成良药,但对良好试验设计的关注确意味着潜在疗法将经过细致的评估以阐明其在目标疾病状态下的风险和收益。 翻阅文献,可以发现由于试验设计不正确,过高或低估了某些药物或疗法的效果,导致长期得不到正确的结论。因此在医学科学研究中,必须借助医学统计学,安排试验,充分考虑影响结果的所有可能条件和因素,制订出一个恰当的临床试验设计,最后才能得出正确的科学结论。此外由于各国的监管要求差异性大,依据当地国家的人种差异和法规差异合理性设计全球多中心临床试验方案将有助于加速药品全球上市。
数据分析不合理(可以避免)
如果有设计良好的临床药物试验但缺失可靠的统计数据能力的情况下,即便未证明潜在新治疗方法的积极疗效和安全性,也不意味着“失败的试验”。反而统计数据薄弱但名义上是积极的结果的试验被称为“失败的试验”,因为它浪费了时间和精力——无法通过监管或同行的审查。仔细的研究设计应减少数据收集和操作中的潜在缺陷,特别是在缺失数据方面。试验者应该牢记并批判性地寻找研究设计中存在哪些潜在缺陷。
基础科学不严谨(可以避免)
团队缺乏专业学科背景,这无疑是公司培训和员工的问题,包括各个团队成员缺乏足够的药物研发知识。CRA也好,CRC也好,大量的研究新人进入该领域,获取专业知识成为了一个重要难题。在缺乏强有力的协调和沟通的情况下,复杂而动态的药物开发过程经常失败。
执行不佳(可以避免)
操作执行该是所有失败试验中最不该出现的因素。包括从试验计划和临床终点到数据解释方面的各种问题,例如单臂,双臂的选择。更为细微的问题比如II期和III期的注册临床终点的切换,II期的生物标记物与临床终点之间的联系不够紧密,导致结果分歧。在临床操作问题方面,例如不遵守良好临床规范和患者入院问题,也会导致后期失败。
资金短缺(无法控制)
完成从药物发现到将药物推向市场的整个开发过程所需的成本各不相同,Hwang T.J.等人通过研究指出,临床Ⅲ启期中有 22% 因资金不足而导致失败。可能因寻求的患者数量、研究地点的数量和位置、试验方案的复杂性以及提供给研究人员的报酬等都有很大差异。实施和监测大型多中心试验直至完成的总成本可能达到 300 至 6 亿美元甚至更多。正是由于财务负担过大,导致许多临床试验还没有得到积极的结果而不得不停止。
招募不力(可以预防)
根据美国国立卫生研究院 (NIH) 的数据,美国80% 以上的临床试验未能满足患者招募时间表。这些延误会增加成本,可能会耗尽资源,并延长进入市场的时间。并且有大量文献报道符合条件的患者少于预期,这可能是由于过高估计患病率、合格参与者的动机较差、对试验干预的有效性的偏见,以及招聘人员和参与者的高负担、无效的筛选、不能向患者解释试验等。尽管资金问题可能无法控制,但试验管理人员可以做很多事情来加强招募,并还有助于节省成本并缓解资金挑战。
战略失误(可以规划)
“战略原因”包括利用已经建立的药物靶点,这表明这些新药失败可能是因为它们与市场上已有的类似药物没有足够的区别。反过来表明,相互竞争的制药公司的研发工作可能存在大量重叠。这往往考验了公司通过经验以及对资料的分析,对竞争格局的判断,还有内部策略等因素来进行的战略规划问题。再例如为什么II期成功在III期也会出现大量失败案例?对于临床试验来说,由于功效不足而失效的化合物在第三阶段的比例应该低于第二阶段,但数据显示恰恰相反。这正是由于战略原因导致的失败。那么如何评估失败产品?有没有足够的信息去评估(大多数情况下是没有完整的数据而必须做出决定)?如何决定是不是要继续投资?……等等问题没有清晰的战略规划都会导致失败。
创新不可避免的要面对风险,原始创新无论是自主研发还是引进,都要走过临床概念验证。安进生物全球开发高级副总裁Rob Lenz曾表示:“临床研究更多地被视为是一种检查工作,但实际上真正的创新临床试验设计方法正在趋于成熟,我们要从固定研究设计转向灵活研究设计,包括:
1、减少或增加剂量
2、增加试验的规模或持续时间
3、丰富研究人群等
“除了使测试药物的潜力更加清晰之外,适应性设计还可以使患者受益。我们越早确信一种药物或一剂药物有效或无效,我们就越早可以推进该药物或停止对患者进行评估。“
(注:所有图片均来源网络,如有侵权请联系删除,文章版权归原作者所有)